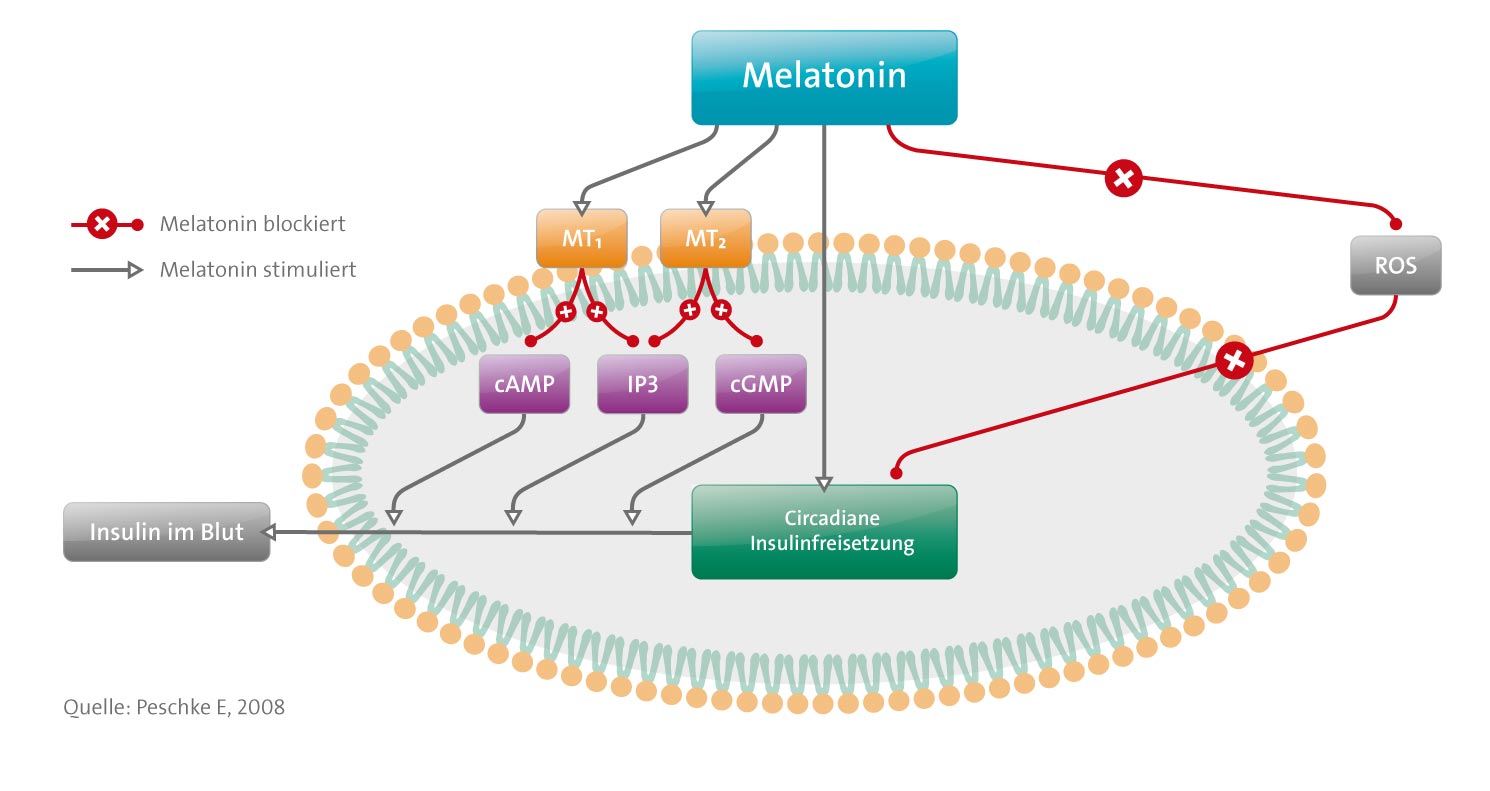
Melatonin beeinflusst die Insulinausschüttung sowohl in vivo als auch in vitro.
- Die Wirkungsweise wird von den MT1- und MT2-Rezeptoren vermittelt.
- Diese wirken spezifisch, haben eine hohe Affinität, sind empfindlich gegenüber Pertussistoxin, sind an das Gi-Protein gekoppelt, hemmen den cAMP-Signalweg und senken die Insulinausschüttung. [Folgende Korrektur wurde nach Online-Veröffentlichung am 4. Dezember 2007 hinzugefügt: «im vorhergehenden Satz wurde ‹erhöhen die Insulinausschüttung› in ‹senken die Insulinausschüttung› geändert.»] Des Weiteren hemmt Melatonin den cGMP-Signalweg, was möglicherweise über Vermittlung der MT2-Rezeptoren geschieht. Dadurch wirkt Melatonin sehr wahrscheinlich hemmend auf die Insulinausschüttung. Ein drittes System, der IP3-Signalweg, wird durch Gq-Proteine, die Phospholipase C und IP3, vermittelt, welche Ca2+-Ionen aus den Speichern im Inneren der Zelle mobilisieren und in Folge zu einer gesteigerten Insulinausschüttung führen.
- Die Insulinausschüttung in vivo, und auch jene aus isolierten Inselzellen, folgt einem circadianen Rhythmus. Dieser Rhythmus, der offensichtlich innerhalb der Inseln generiert wird, wird von Melatonin beeinflusst. Letzteres bewirkt eine Phasenverschiebung bei der Insulinausschüttung.
- Die Beobachtung der circadianen Expression von Uhrgenen im Pankreas könnte möglicherweise ein Hinweis darauf sein, dass die circadianen Rhythmen in den Inselzellen des Pankreas selbst ihren Ursprung haben.
- Melatonin hat einen Einfluss auf Diabetes und die damit assoziierten Stoffwechselstörungen. Die diabetogenen Substanzen Alloxan und Streptozotocin führen zu einer selektiven Zerstörung der Betazellen, indem sie sich in diesen Zellen anreichern und dort die Bildung von ROS induzieren. Betazellen sind äußerst anfällig gegenüber oxidativem Stress, da sie eine nur sehr geringe antioxidative Kapazität aufweisen. Die bisherigen Ergebnisse deuten darauf hin, dass eine Verabreichung von Melatonin in pharmakologischen Dosen Schutz gegenüber ROS bietet.
- Abschließend ist zu sagen, dass die Melatoninkonzentration im Plasma und auch die Aktivität der Serotonin-N-Acetyltransferase (AANAT) bei diabetischen Ratten bzw. Menschen niedriger sind als bei Ratten bzw. Menschen ohne Diabetes. Im Gegensatz dazu ist in der Hypophyse die mRNA von AANAT erhöht und die Insulinrezeptor-mRNA herabgesetzt, was wiederum auf eine enge Verbindung zwischen Insulin und Melatonin hinweist.